肥胖已成为全球最严重的公共卫生问题之一。迄今为止,已有将近三分之一的世界人口处于超重或肥胖状态。肥胖易引起代谢综合征(胰岛素抵抗、糖耐受、高血脂、高血压和脂肪肝),大幅增加心脏病、脑中风、糖尿病和癌症等致命性疾病的患病风险。据统计,每年至少有280 万人死亡可归咎于超重或肥胖。肠道是机体重要的营养吸收器官,过多的能量摄入或脂肪吸收势必会促进肥胖及代谢性疾病的发生。越来越多的研究表明,生物钟参与机体能量稳态的调节。然而,肠道生物钟在脂质吸收和能量稳态中的作用及其机制尚不明确。
近日,我校77779193永利官网分子节律与代谢研究所吴宝剑教授团队以77779193永利官网为第一单位在Nature Communications(IF=14.919)发表了题为“Deficiency of intestinal Bmal1 prevents obesity induced by high-fat feeding”的研究成果。研究者揭示了肠时钟因子BMAL1通过直接转录激活甘油三酯合成限速酶DGAT2表达,促进膳食脂肪吸收,进而诱导高脂饮食小鼠肥胖;而肠时钟因子REV-ERBα可抑制BMAL1对DGAT2的激活作用,抑制脂肪吸收,从而减轻高脂饮食小鼠肥胖症状。此外,小分子SR9009靶向肠道REV-ERBα/ BMAL1可改善高脂饮食诱导的小鼠肥胖。吴宝剑教授为该文的通讯作者,喻芳君博士为第一作者。

研究者首先基于时钟基因Bmal1肠特异性敲除(Bmal1iKO)鼠及对照鼠,发现在等热量高脂饮食诱导下,对照鼠表现为肥胖并伴有代谢紊乱症状(血脂异常升高、脂肪肝等),而Bmal1iKO小鼠的肥胖与代谢紊乱症状较轻。作者还发现限制夜间进食(仅在小鼠活动期进食)的喂养制度可缓解高脂饮食诱导的小鼠肥胖,这与BMAL1在肠表达的节律性(昼高夜低)有关。在机制探索中,作者发现Bmal1肠特异性敲除并未影响小鼠的摄食行为、自主活动及能量消耗,而显著降低了肠道脂质吸收。
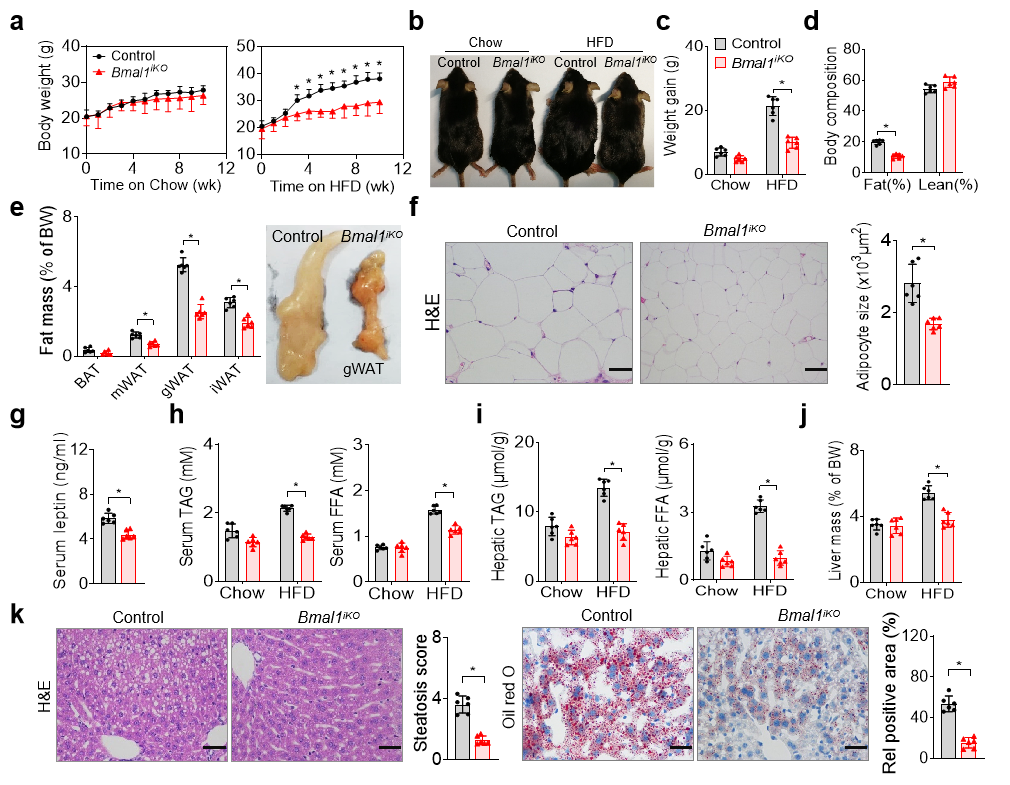
随后基于脂质吸收通路分析,阐明了肠道甘油三酯合成限速酶DGAT2的表达差异是脂质吸收及肥胖表型差异的原因。肠DGAT2介导的甘油二酯向甘油三酯转化是脂质吸收的重要环节,肠特异性Bmal1敲除显著降低DGAT2的表达及节律,从而抑制脂质吸收,进而抵抗肥胖。深入的机制研究表明,BMAL1通过直接转录调控DGAT2的表达,从而调控脂质吸收与肥胖。
此外,作者还揭示时钟基因Rev-erbα肠特异性敲除与Bmal1肠特异性敲除的表型恰恰相反:Rev-erbαiKO小鼠经高脂饮食诱导后肥胖症状加剧。机制研究发现,REV-ERBα通过抑制BMAL1的表达,进而抑制DGAT2的表达,从而抑制脂质吸收与肥胖。小分子激动剂SR9009灌胃可靶向肠REV-ERBα/BMAL1/DGAT2通路进而改善高脂饮食诱导的小鼠肥胖。
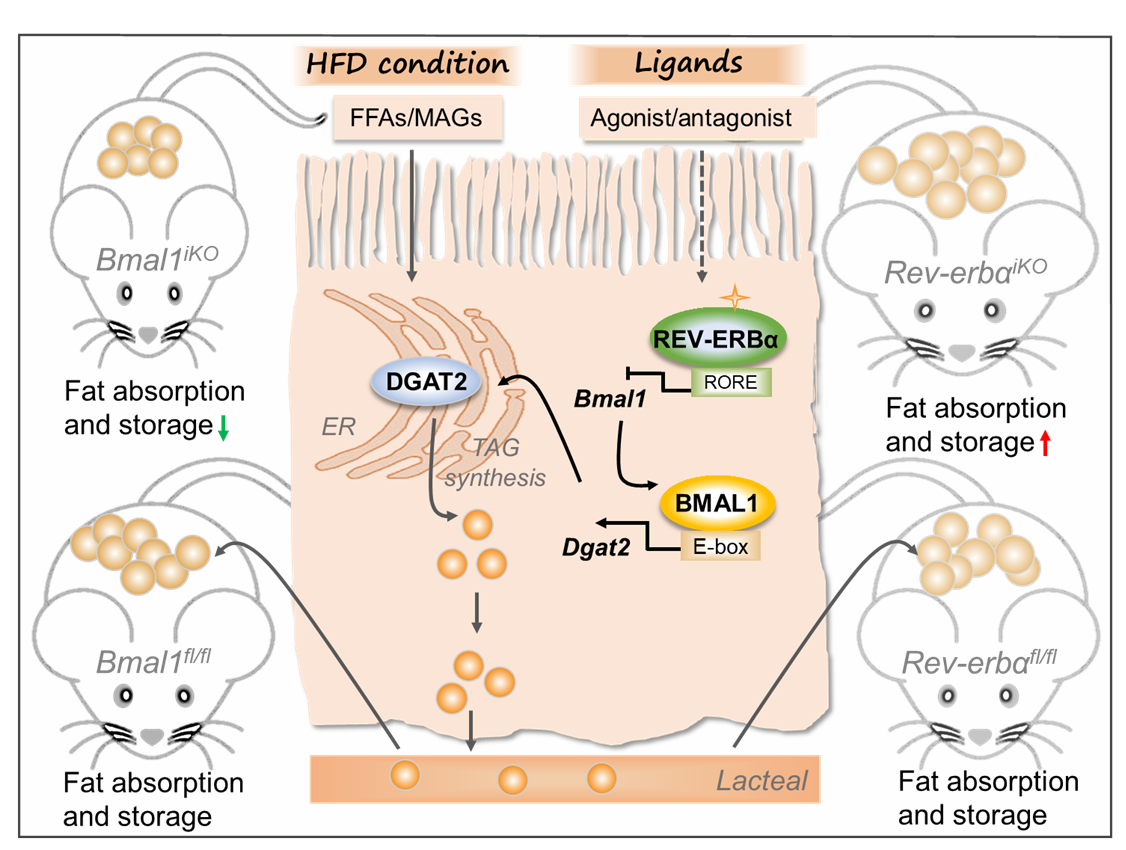
综上,肠时钟因子BMAL1和REV-ERBα作为生物钟系统的重要正负元素,在脂质吸收与机体能量稳态中发挥重要作用,两者的平衡对机体健康至关重要。这一研究成果不仅拓展了人们对肠道核心生物钟节律蛋白生理功能的认识,也加深了人们对肥胖形成机制的理解,同时为肥胖的预防和控制提供了新的药靶。
文章链接:
https://www.nature.com/articles/s41467-021-25674-5